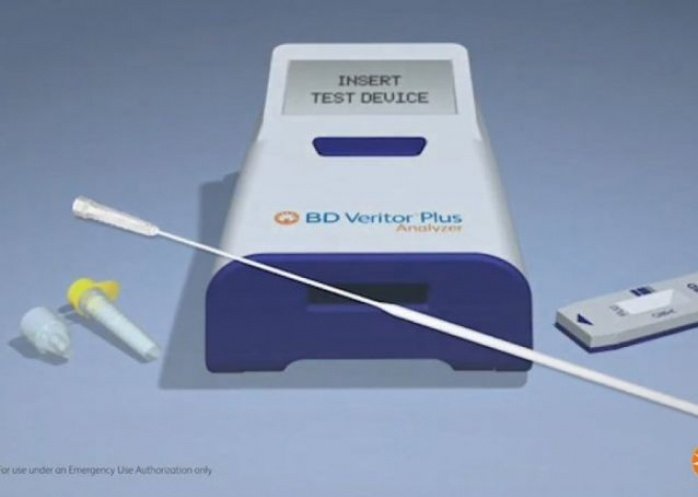
Permite detectar el virus de SARS-CoV-2 activo, a partir de un hisopado nasal poco invasivo, que luego se analiza con un equipo para lectura digital del tamaño de un posnet operado por un profesional de la salud.
Llegó al país un nuevo test que permite detectar el virus SARS-CoV-2 en tan sólo 15 minutos, y ya fue aprobado por la ANMAT y la FDA. El método de examen es poco invasivo, ya que se realiza hisopando las fosas nasales. El procesamiento de la muestra es muy sencillo y la lectura del resultado se realiza en el dispositivo portátil BD Veritor Plus Analyzer, desarrollado por la compañía norteamericana Becton Dickinson.
“Estamos muy entusiasmados por presentar esta nueva propuesta de test en la Argentina, porque la incorporación de esta técnica nos permitirá ampliar la capacidad de diagnóstico en el país. Es una variante complementaria al PCR, que presenta características diferenciales en comparación con la biología molecular. Esta prueba de antígenos tiene como valor destacado su rapidez de respuesta, ya que emite el resultado en 15 minutos. Además, al ser un dispositivo pequeño y de fácil manejo, permite su uso en cualquier ámbito de un centro de salud, sin necesidad de contar con la complejidad de un laboratorio, y es entre un 30% y un 40% más económica”, explicó en exclusiva para Infobae Leandro Zuza, director de la Unidad IDS en Becton Dickinson para Cono Sur.
Este nuevo test tiene un costo inferior al test por PCR y permitirá ampliar de manera significativa el acceso al diagnóstico en el país. Asimismo, debe considerarse que es de uso exclusivo para profesionales de la salud (habilitados para realizar el diagnóstico) e instituciones sanitarias.
“Estamos comenzando a transitar las primeras experiencias en el país, tanto con instituciones del sector público como privado. Como experiencia previa, los tests de BD ya están siendo utilizados en Estados Unidos de forma positiva en diferentes centros de salud, como también en lugares como geriátricos o por el ejército, siempre en manos de profesionales de la salud para brindar el diagnóstico correcto. Nos complace también contar que Latinoamérica es una de las regiones que la compañía prioriza, por eso es que esta tecnología ya está disponible en la Argentina y otros países de la región como Chile, Colombia y Perú. Hoy, en la primera partida disponible en nuestro país, ya contamos con una capacidad diagnóstica de 55 mil testeos, pero en función de las necesidades puntuales y demanda local, la compañía aumentará el abastecimiento significativamente”, detalló Marco Musitano, director general BD Cono Sur.
“Es una tecnología innovadora a nivel mundial que detecta el virus SARS CoV2 dentro de los cinco días desde el inicio de los síntomas. El dispositivo es de lectura fácil y objetiva en pantalla digital y permite imprimir o exportar el resultado a un sistema informático, lo cual posibilita una mejor y más rápida trazabilidad de posibles contagios. Además, favorece la intervención rápida y el manejo correcto de los pacientes con COVID-19”, agrega Marco Musitano.
“Otra característica fundamental es que la prueba posee un valor predictivo positivo (VPP) del 100% y un valor predictivo negativo (VPN) del 97,5%. Esto significa que el resultado positivo es sin duda positivo, y que existe un muy pequeño margen en el cual un resultado negativo es presuntivo”, explica Leandro Zuza.
“A diferencia de un test serológico –cuyo objetivo es la detección de anticuerpos en un individuo que ya tuvo contacto con el virus– esta prueba de antígenos identifica a personas con el virus SARS-CoV-2 activo con mayor celeridad que una prueba de PCR, cuyo resultado puede demorar varias horas y/o días”, agrega Zuza.
Esta técnica de diagnóstico está disponible mundialmente desde hace más de 10 años y es utilizada para la detección de otros virus respiratorios, como el virus influenza. Esta actualización, que incorpora el reactivo para la detección de COVID-19, cuenta con la Autorización de Uso de Emergencia de la FDA (Food and Drug Administration) de los Estados Unidos de América y se encuentra en el Listado de Productos autorizados por ANMAT (Administración Nacional de Medicamentos, Alimentos y Tecnología Médica) para COVID-19. Ya está disponible y siendo empleada con éxito en diversas instituciones de Estados Unidos, y se implementará también en varios países de Latinoamérica (Brasil, Chile, Colombia, México y Perú), debido a que esta región es considerada uno de los mercados prioritarios para la compañía.